低リスク前立腺癌に対する私の考え
グリソンスコアが3+3である低リスク癌は治療を行わなくても、転移したり癌が進行して死に至る可能性が非常に稀な前立腺癌と考えられています。そのため下記に述べるように低リスク前立腺がんに対しては基本 監視療法を採択し、経過中 再検査により治療の必要がある中間リスク以上にリスクが上がるようなら治療を考慮することとしています。小生は、たとえ高精度で安全性の高い小線源治療であっても、不必要な治療・手術を患者さんに行うべきではないと考えるからです。”治療の必要のない方に侵襲を伴う医療行為を行うことは、例え治療により完治得られたとしても是とすべきではない” という信念に基づく方針です。
高リスク前立腺癌に対する私の考え
PSA20ng/ml以上、臨床病期がT3a以上、もしくはグリソンスコアが8以上の癌は高リスク前立腺癌と呼ばれ、従来の治療方法では再発率が高い難治性の癌(前立腺全摘手術後の再発率が60%、IMRTなどの外部照射治療後の再発率が50%)であると報告されています:詳細は私が監修している下記のサイトをご覧下さい。しかし長期に渡る観察結果から、こういった高リスク前立腺癌に対しては、小線源治療と外部照射を組み合わせた超高線量照射を行うことにより治癒率を高めることができるというデータが先のマウントサイナイ医科大学をはじめとする欧米の施設から公表されています(図1)。
高リスク前立腺がんに関する欧米主要施設での治療法別データ
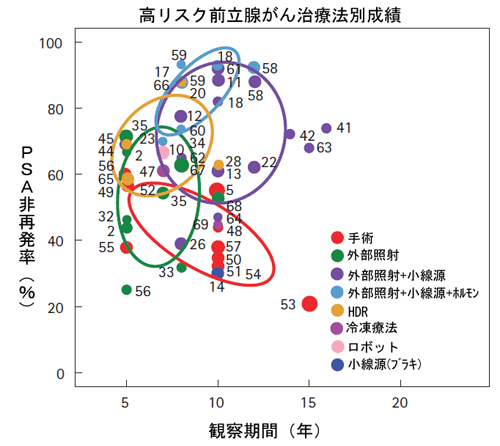
図1: Prostate Cancer Results, Study Group の解析による高リスク前立腺がんに関する
欧米主要施設での治療法別データ
Grimm, P, et al., BJUI, vol .109 (s) pg. 22-29, Feb2012 欧米主要施設での治療別データより一部改変
外部照射のデータは3D-CRTもしくはIMRTで線量は72~81Gy
拙者監修:ブラキサポートから引用 前立腺がん治療・小線源療法|ブラキ・サポート高リスク前立腺がんの治療法別成績【1】|ブラキ・サポート監修者の紹介|ブラキ・サポート
高リスク癌および超高リスク癌に対するトリモダリティ治療
小線源治療と外部照射を組み合わせた超高線量照射は、外部照射のみによる放射線治療に比較して遥かに高いエネルギーが照射できるというメリットがあります。こういった超高線量照射にホルモン治療を併用すること(高リスク癌に対するトリモダリティ治療)で非常に優れた治療成績が示されています(図1)。 私はこれまで高リスクおよび超高リスク症例に対して長年にわたりトリモダリティ、すなわちホルモン治療+小線源+外部照射による治療 を行ってきました。一定期間のホルモン治療が必要となるPSAが100ng/mlを超えるような超高リスクでも小線源治療終了後、原則6ヶ月以内にホルモン療法を休止としなるべくホルモン療法の副作用を必要最小限に留めるように配慮してきました。その成果を論文化することにより、外部照射治療の主流であるIMRTや粒子線治療でおこなわれている治療後2年以上継続される長期のホルモン療法は岡本メソッドによるトリモダリティではまったく必要がないことをを国際雑誌の中で主張してきました。
いっぽう我が国でも高リスク症例に対して、ホルモン療法、小線源治療と外部照射を用いたトリモダリティ治療を施行している施設は散見されますが、問題はトリモダリティによって如何に高い線量を安全に投与できるか?という点が非常に重要になります。私は既に数多くの高リスク症例を高線量のトリモダリティ治療で完治させてきました。8年近くみた私のデータでも欧米のデータ (図2)同様小線源治療を用いた超高線量照射は外部照射単独 (強度変調放射線治療:IMRT)や手術療法にくらべて再発率や局所コントロールという点で非常に優れた治療法です。これまで高リスク前立腺癌 に対して私がトリモダリティ治療をおこなった結果5年のPSA非再発率は95.2% で再発症例は全例が診断時に同定できなかった遠隔転移(骨転移)による再発という結果でした(Journal of Cotemporary Brachytherepy, 2017):さらに、この論文では診断時に遠隔転移がなければ治療対象症例としていますので他施設のトリモダリティ治療の報告や高リスク前立腺癌に対する治療成績に比べて、局所進行癌症例が数多く含まれています。すなわち対象症例はT3a より進行した精嚢浸潤のあるT3b, 膀胱浸潤のあるT4, また骨盤内リンパ節転移のある症例、PSA>100といった、他施設では小線源治療の適応にならない超高リスク症例を相当数含んでいます。High biologically effective dose radiation therapy using brachytherapy in combination with external beam radiotherapy for high-risk prostate cancer – PMC
具体的には、本論文が対象とした143例はPSAの平均値が20ng/ml以上でありPSA値が100ng/mlを超える症例も含まれ、ステージでいえばT3a以上 (T3a, T3b, T4) の局所進行前立腺癌症例が63%を占めています。また骨盤内リンパ節転移を伴う症例も5症例含まれています(これらリンパ節転移を有していた5症例はいずれも、後に述べるような全骨盤への外部照射を併用したトリモダリティ治療を行うことにより再発なく経過しています:代表的なリンパ節転移を認める症例として骨盤内を占拠し精嚢浸潤を伴う局所進行前立腺癌T3bN1:治療前PSA=65ng/mlであった症例の完治例が本論文のFigure 2に提示してありますので御覧いただければ幸いです)。
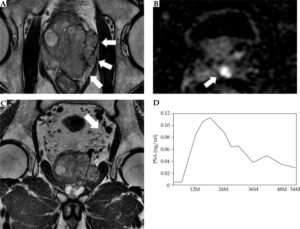
Representative T3bN1 case treated by tri-modality with whole pelvis external beam radiotherapy (EBRT). Case: 68-yearold man with initial prostate-specific antigen (PSA) 65 ng/ml. The needle biopsy Gleason’s score was 4+4. Clinical stage was T3bN1. Magnetic resonance imaging shows (A) a bulky prostate tumor extending over the capsule and compressing the rectal wall (B) with seminal vesicle invasion, and (C) nodal metastasis as indicated by white arrows. The patient was treated by combination therapy with low-dose-rate (LDR) brachytherapy, whole pelvis EBRT, and androgen deprivation therapy (ADT). Upon seeds implantation, they were implanted in seminal vesicle as well as prostate [15]; (D) PSA change after treatment: PSA shows temporal increase after cessation of ADT, but continuous decrease was observed thereafter. Y axis shows the period (months) from completion of the EBRT
さらに58%の症例が高リスク因子を2つ、もしくは3つ有する症例でした。つまりこれらは私が治療手がけた高リスク症例のうちのトリモダリティ治療を行わざるを得なかった症例のデータであり、ホルモン療法を使わず小線源と外部照射の併用、もしくは小線源単独で完治している高リスク症例は含まれていませんので、すべての高リスク症例を集計して計算するとさらに非再発率は高くなるものと予想されます。従って他施設の高リスク前立腺癌に関する治療成績と比較される場合は、各施設のデータにおいてどの程度の重症高リスク前立腺癌を調査対象症例に組み入れているかという症例背景の差異を考慮する必要があります。小生は、他施設において小線源治療やトリモダリティ治療の適応外と判断された難治性前立腺癌症例の多くを完治に導いてまいりました(もちろんこれら困難な症例の中には診断・治療時には画像上わからなかった潜在的骨転移を有する症例が一定の確率で存在し、こういったケースでは治療後再発という経過を辿ってしまうことは止むを得ません:上述の高リスク論文で再発した6症例は全例このような潜在的骨転移の存在が原因でした)。 上述の2017年に国際誌に公表した高リスク症例のお一人でPSA>20ng/ml, T3a, グリソンスコア4+5であった方のインタビュー(下段)がありますので参考になさってください。この方は小生のトリモダリティ治療後10年以上経過していますが、再発や、血尿・血便といった副作用もなく、元気に奥様とお暮しになっておられます。このほか、膀胱に浸潤した前立腺癌はT4と分類され明確に完治した症例の報告は調べ得た限りではないのが現状ですが、全骨盤への外部照射を併用したトリモダリティ治療により精嚢浸潤(+)、膀胱浸潤(+)、骨盤内リンパ節転移(+)つまりT4N1症例の完治症例も国際誌に公表しています(Journal of Cotemporary Brachytherapy, 2021)。Prostate cancer with nodular bladder invasion (stage T4N1) cured by low-dose-rate brachytherapy with seminal vesicle implantation in combination with external beam radiotherapy of biologically effective dose ≥ 220 Gy: a case report – PMC
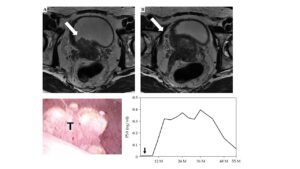
Axial T2-weighted magnetic resonance images of the prostate. A) A large prostate tumor with hypo-intensity extended into the right bladder wall. The white arrow indicates the invasion of prostate cancer into the bladder. B) Bilateral seminal vesicles invasion. A lymphadenopathy is also observed in the right obturator lesion suggesting pelvic node lymph node metastasis (white arrow). Cystoscopy findings of the nodular bladder invasion of prostate tumor. A) An irregular surface of solid and nodular tumor is located in the right trigone, near the bladder neck. T – nodular bladder invasion of the prostate tumor. Prostate specific antigen (PSA) change after the treatment.Y axis shows PSA values. X axis indicates the period(months) after EBRT completion. The black arrow shows cessation of ADT. PSA indicates temporal increase after cessation of ADT, but continuous decrease was observed thereafter. PSA at the latest follow-up (six years after the completion of EBRT) is 0.01 ng/ml: Testosterone level recovered to the normal range value at 9 months after cessation of ADT
T3b やT4 は超高リスク前立腺癌に分類されますが、病期分類がT3b やT4といった局所進行前立腺癌にトリモダリティ治療を運用する場合、精嚢にシードを留置するという高度な技術が必要となります。この技術を持ち合わせていない施設および術者では、T3b やT4症例はトリモダリティ治療の適応外とされているのが現状であり、仮に小線源治療を運用しても精嚢が治療されていない場合、前立腺癌が精嚢に再発してしまいますので注意が必要です。また例え画像診断で精嚢浸潤なし、T3aと診断された場合でも、精嚢近傍や前立腺底部(膀胱よりの前立腺)から前立腺癌が検出されている場合は、ある程度のシードを精嚢に留置し、精嚢も治療しておくべきであるというのが私の方針です。こういった治療方針を徹底した結果、過去10年以内に臨床再発と診断された症例において精嚢に再発された症例は皆無です。以上を纏めますと、岡本メソッドによる治療戦略を適応することによりこれまでPSAが300ng/ml 超える症例や骨盤内リンパ節転移を伴った症例であっても高い確率で、早期にホルモン治療から解放され、排尿機能や性機能といったQOLが保たれた真の意味での完治を獲得されておられるわけです。また上に症例提示をしたT3bN1, T4N1やT3b導管癌などは、私が調べ得た範囲では国内外で長期間を経て完治を得ている症例報告は見当たりません。単に非再発率を論文で提示させるだけではなく、他施設では到底根治が得られないような難治症例を完治させていることを明確に提示するという意味でこういった症例報告は、統計解析論文に勝るとも劣らない価値があると考えています。
繰り返しになりますが、岡本メソッドでは骨転移や臓器転移さえなければ上述のような難治症例や骨盤内リンパ節転移を認める症例であっても、ホルモン治療の期間は小線源終了後から6か月と短い治療で完治させることが出来るのが特徴です。また前立腺癌の中には導管癌と呼ばれる悪性度が高くまた再発率および死亡率の極めて高い前立腺癌が存在します。いわゆる難治性前立腺癌に分類されるものです。私は局所進行をきたした超高リスク導管癌 (T3b症例)についても同様のメソッドを用いることにより、長期間の経過観察を経ても完全に根治できていることを国際雑誌に公表しました:(Journal of contemporary brachytherapy 2022)。Very high-risk locally advanced prostate ductal adenocarcinoma cured using low-dose-rate brachytherapy, with seminal vesicle implantation in combination with external beam radiotherapy at a biologically effective dose ≥ 220 Gy: two case reports with a long-term follow-up – PMC
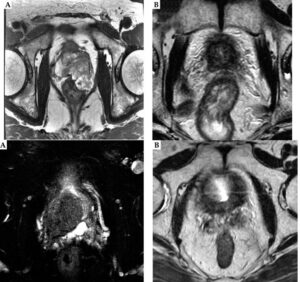
The Upper Image: Axial T2-weighted magnetic resonance images of the prostate of case 1. A) Locally advanced prostate ductal adenocarcinoma (PDA) before the treatment. Note that a large prostate tumor extends into the rectal wall (T3b); B) The shrinkage of the tumor observed at 11 years after the treatment. The Lower image: Axial T2-weighted magnetic resonance images of the prostate of case 2. A) Locally advanced prostate ductal adenocarcinoma (PDA) before the treatment. Note that a large prostate tumor extends into the right seminal vesicle (T3b); B) The shrinkage of the tumor observed at 8 years after the treatment.
At their latest follow-up evaluations (case 1 at 11.5 years after completion of EBRT, and case 2 at 8 years after completion of EBRT), PSA values in both the patients were 0.01 ng/ml (Table 3). Serum testosterone values of both the patients were within normal range (Table 3), indicating that the effect of ADT on the above-mentioned low PSA level was negligible.
一方、IMRTや重粒子線治療などの高額ハイテク外部照射治療では、治療後も非常に長期間ホルモン療法を行うのが一般的ですが、治療後長期のホルモン療法を行うことにより、さまざまな問題点が生じてきます。放射線治療終了後も2年から3年という異常に長い期間ホルモン療法を続けた場合 1) 治療後、低いPSA値が長期間持続していても、単に長期ホルモン療法の影響で男性ホルモン(テストステロン)が回復していないことによるPSA抑制効果をみているに過ぎないことがあります。つまり治療後相当な年月を経て患者さんのPSA値が低く維持されていても真の治癒とは言えない場合が多く、患者さんや担当医にとって”本当に前立腺癌は完治したと言えるのだろうか?” というジレンマが生じます。2) さらに長期のホルモン療法による全身的副作用が、患者さんにとって深刻な問題を引き起こす危険性があるという大きな問題があると考えます。放射線治療の場合、前立腺癌細胞を完全に死滅させられるかどうか(すなわち再発を起こすか起こさないか)は、前立腺に照射する放射線の線量(Gy)で決定されますので高い精度で高線量を照射できる小線源治療を使ったトリモダリティ治療は、むやみに長期間のホルモン療法を行わずとも安全に高リスク前立腺癌を完治・根治させることのできる治療といえまます。ちなみに上述した私のT4N1(膀胱浸潤があり、骨盤内リンパ節にも転移を認める)症例や導管癌の完治症例ではテストステロンが正常値に回復していることを確認した上でPSAが極めて低い値を示していることから真の完治すなわち根治が得られているといえるわけです。 もう一点、重要なことは、T4N1(膀胱浸潤があり、骨盤内リンパ節にも転移を認める)症例や導管癌の完治症例の最終PSA値は0.01ng/ml と非常に低い値であり、前立腺全摘手術の再発定義である0.2ng/mlより遥かに低い値を示しています。このことは2017年に私が公表した高リスク論文(Journal of Cotemporary Brachytherepy, 2017) の中で取り上げているPSA=65ng/ml, T3bN1(精嚢浸潤と骨盤内リンパ節転移のある)症例でも同様です。全摘手術と放射線治療のPSA再発率の差を議論する際に全摘手術のPSA再発定義(0.2ng/ml) と放射線治療のPSA再発定義(2.0 ng/ml) の差を問題にする研究者が少なからず存在します。しかしながら、私の経験では、適切かつ高線量の小線源治療をおこなえばこのような難治性の前立腺癌はもちろん中間リスクの前立腺癌でも、治療時点で隠れた転移さえなければ、十分な観察期間をおけば全摘手術のPSA再発定義(0.2ng/ml) 以下に低下し、多くの症例におけるPSA値は最終的に測定感度以下まで低下します。つまり岡本メソッドによる小線源治療では、最終的に全摘手術のPSA再発定義(0.2ng/ml) を遥かに下回る非常に低いPSA値に到達することを確認しています。最近の治療例を挙げれば治療前PSA=494ng/ml, T3bN1(精嚢浸潤とリンパ節転移あり), グリソンスコア4+5という超難治症例に対して全骨盤への外部照射を併用したトリモダリティ治療を行った結果外部照射終了後3年を経過した時点でのPSAは0.1ng/ml以下になっています (テストステロンは正常値)。
前立腺癌と診断されて悩んでおられる 患者とご家族の方々に是非、理解していただきたいのは 以下に述べるポイントです。1)放射線治療や手術療法の再発定義や、ホルモン療法や化学療法の効果が持続している状態で論文発表されている一見良好な非再発率という見せかけの数字に騙されないように注意しなければなりません。特に放射線治療後を起点に非再発率を算出している論文で放射線治療後も2から3年ホルモン療法が継続されている場合は要注意です。 2) 診断時骨転移や遠隔転移がなければ、岡本メソッドによる小線源治療を受けられれば、前立腺癌はPSAが100ng/mlを超え骨盤内リンパ節転移陽性症例であっても高い確率で再発の不安のない真の完治と根治(男性ホルモンの値が回復してもなおPSAの値が低値であること)が得られるというエビデンスが、複数の専門家による査読を経て受理された英文医学誌への公表論文を通じて国際的にも認められているという二つのポイントです。もう一点、非再発率という1)のポイントに関して言及するならば、治療終了直後の症例も解析対象に入れてしまうのと、最低の経過観察期間を治療終了から少なくとも2年とするのでは明らかに前者の非再発率が見かけ上、高く計上されてしまいますので、医学論文における非再発率の数値解釈には注意が必要です。
中間リスク前立腺癌に対する私の考え
低リスク、高リスク以外の転移のない前立腺癌は中リスク前立腺癌に区分され、一般的にはPSAが10-20ng/mlもしくはグリソンスコアが7の癌がこのグループに相当します。この中間リスク前立腺癌においても標準治療である外科手術や外部照射治療後の再発はかなりの確率でみられ、前立腺全摘手術後の再発率が30%、IMRTなどの外部照射治療後の再発率が30%であると報告されています:詳細は私が監修している下記のサイトをご覧下さい。
中リスク前立腺がんに関する欧米主要施設での治療法別データ
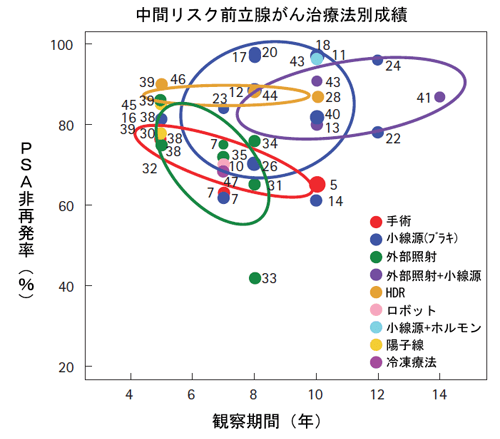
図2: Prostate Cancer Results, Study Group の解析による中間リスク前立腺がんに関する
欧米主要施設での治療法別データ
Grimm, P, et al., BJUI, vol .109 (s) pg. 22-29, Feb2012 欧米主要施設での治療別データより一部改変
外部照射のデータは3D-CRTもしくはIMRTで線量は72~81Gy
拙者監修:ブラキサポートから引用前立腺がん治療・小線源療法|ブラキ・サポート中間リスク前立腺がんの治療法別成績|ブラキ・サポート|ブラキ・サポート監修者の紹介|ブラキ・サポート
小線源治療を含めた放射線治療を非転移性の前立腺癌に対する一次治療として選択する場合、再燃に対しての治療法がホルモン療法に限られる事から、再発をおこさない治療を行うことがきわめて重要と考えられます。治療にあたって、私は再発をおこさないよう高精度の治療を行うことに細心の注意をはらっています。中間リスク前立腺癌に関しては基本的に放射線の線量さえ高く設定できればホルモン治療なく確実に完治しますので中間リスクにはホルモン治療をおこなうことなく小線源単独治療で対応しています。
高線量小線源単独治療
以上のような観点から、各リスクの前立腺癌については完治に至る十分な線量を照射できる治療法の選択を患者さんにアドバイスしています。私が独自に開発した小線源単独治療のメソッドは、他施設に比べて高線量(D90=195-210Gy: D90とは前立腺の90%に照射された線量を意味します)で治療をおこなっています。この線量は外部照射相当で100Gyを遥かに超える線量に匹敵します。そのため中間リスクでも外部照射の併用なしで完治を得ることが可能です。滋賀医大時代の初期症例では中間リスクに対して外部照射を併用するやり方を採択していましたが、現在私は、ほとんどの中間リスクの患者さんに対してホルモン治療や外部照射の併用をおこなうことなく小線源のみで完治させています。つまり中間リスクのうち前立腺全摘手術やIMRTなどの外部照射では、再発率が高いとされるグリソンスコアが4+3の中間リスク群であっても7年の経過観察で非再発率99%というデータを国際雑誌に発表しています (Journal of contemporary brachytherapy 2020) Clinical outcomes of low-dose-rate brachytherapy based radiotherapy for intermediate risk prostate cancer – PMC
私はこの論文において、高い線量(BED=200Gy)で治療できるならグリソンスコアが4+3の症例であっても中間リスク前立腺癌においては、ホルモン療法も、外部照射も不要であることを実証しました。下記に私が開発した独自の線源留置方法であるTen Step Method(いわゆる岡本メソッド)を用いた高線量小線源単独治療の線量分布を示します。この方法の詳細はTen-step methodとして国際誌に公表しています Ten‐step method of high‐dose LDR 125I brachytherapy for intermediate‐risk prostate cancer – PMC
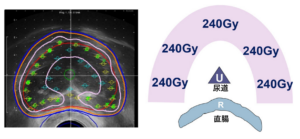
Ten Step Method による線量分布 赤のライン:前立腺被膜、ピンクのライン:240Gy、オレンジのライン:160Gy、ブルーのライン:144Gy. Okamoto K, J Appl Clin Med phys 2021より改編
この図では 岡本メソッドを用いて被膜のギリギリ内側に線源を丁寧に配置することにより、ほとんどの部位で最低でも被膜外側5mm以上(~10mm) の領域が160~200Gyの線量で治療できていることを示しています。つまり岡本メソッドによる高線量小線源単独治療を運用することにより、前立腺全摘手術の術後に被膜外浸潤や断端陽性 (手術後の説明でこのような結果を受けた患者さんは術後長きに渡り再発の不安と葛藤せねばならなくなり精神的不安が長きに渡り襲いかかるので注意が必要です)と診断されるような症例であっても、局所再発の不安のない確実な完治をもたらすことが可能なのです。
岡本メソッドによる小線源単独高線量治療を運用することにより、グリソンスコアが4+3の中間リスク症例であっても外部照射という通院、入院の手間なく、さらにホルモン療法による高額医療費とホルモン療法の副作用なく完治できるので、体の負担が少ないことはもちろんのこと、経済的にも時間的にも非常に多くのプラス面が多くあります。ただこの高線量照射は十分な知識・経験と高い技術がなければ、強い副作用や傷害が出る可能性があり、どの治療施設でも実施できるわけではありません。
私は、小線源単独あるいは小線源と外部照射の併用のいずれの場合であっても局所再発をゼロにするよう格段の配慮をもって治療にあたっています。また高リスク以外の前立腺癌については ホルモン療法はおこなわないという方針で治療しています。その理由としてホルモン療法には骨粗鬆症や心血管系への副作用以外にも高脂血症、耐糖能異常、認知力低下、骨髄機能低下などのさまざまな副作用があるからです。我々は中間リスクや大きな前立腺であっても極力ホルモン治療をおこなうことなく治療できる経験と技術を備えています。
ここまで述べたように、岡本メソッドを使った小線源治療は限局がんのみならず局所進行がんや骨盤内リンパ節転移をともなった進行前立腺癌も完治の対象としています。そして中間リスクと高リスク、および骨盤内リンパ節転移を伴った超高リスク前立腺癌を非常に高い確率で根治・完治させる治療法ということにになります。 他の治療方法と比較した場合 こういった困難な症例においても、岡本メソッドによる小線源治療を運用することにより、圧倒的に高い非再発率すなわち高い根治率と完治率が得られることを、上に紹介した国際雑誌に公表しています。これまで岡本メソッドをもちいた小線源治療を運用することにより、診断時や治療前に画像でわからない遠隔転移がなければ 高い確率で”再発なし” ”前立腺癌の完治・根治”を達成してきた背景と根拠には多くの症例実績のみならず長期観察を経たデータとエビデンスが査読を通して国際雑誌に承認されたゆるぎない公表結果に基づいていることを理解していただければ幸いです。